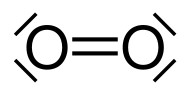|
La découverte de l'oxygène |
L'oxygène relève d'entrée de jeu d'un certain nombre de malentendus
ce qui, en effet, est quelque peu gênant.
|
Pour commencer, le nom
est inexact: on parle d'oxygène alors qu'il conviendrait le
plus souvent de parler de dioxygène. Le gaz, la molécule,
qui constitue 20,9 % du volume de l'atmosphère terrestre au
niveau de la mer est en effet constitué de deux atomes
d'oxygène reliés par liaison covalente. |
|
En second lieu, le terme
d'oxygène - du grec oxy "acide" et gène "engendrer" -
relève d'une erreur d'appréciation du scientifique Antoine Lavoisier
qui nomma ainsi la molécule en 1777: « Nous avons donné à la base
de la portion respirable de l'air le nom d'oxygène [...] parce qu'en
effet une des propriétés les plus générales de cette base est de
former des acides en se combinant avec la plupart des substances.
Nous appellerons donc gaz oxygène la réunion de cette base avec le
calorique. »
Or l'oxygène n'engendre pas de
l'acide mais des oxydes, c'est-à-dire des composés de l'oxygène
avec un élément moins électronégatif que lui. L'oxygène a capacité à
former très facilement des composés avec tous les autres éléments
chimiques, sauf le fluor qui possède la plus forte
électronégativité.
Très répandus, la plupart des
minéraux connus sur Terre sont en réalité des oxydes: oxyde de fer
pour la rouille, oxyde d'aluminium pour le corindon ou oxyde
d'hydrogène pour...
l'eau H2O!
|
Même la parenté de la
découverte de l'oxygène est erronée. On l'attribue le plus
souvent au pasteur britannique Joseph Priestley
(1732-1804). En 1774, il provoque la libération d'un gaz
qu'il nomme « air déphlogistiqué » en faisant converger les
rayons du Soleil vers un tube en verre contenant de l'oxyde
de mercure (HgO). Il constate que la flamme des bougies est
plus brillante dans ce gaz et que les souris y gagnent en
énergie et en longévité. L'ayant lui-même respiré, il écrit:
« la sensation dans mes poumons n'était pas sensiblement
différente de celle de l'air ordinaire mais j’eus
l'impression que ma respiration était particulièrement
légère et facile pendant un certain temps par la suite
». La première expérience d'oxygénation cellulaire ?
L'oxygène fut en
réalité découvert deux ans plus tôt par le chimiste suédois
Carl Wilhelm Scheele (1742-1786) . En 1772, il
produisit du dioxygène en chauffant de l'oxyde de mercure
avec divers nitrates et nomma nomme ce gaz « Feuerluft » ou
« Air de feu », en référence à son rôle de comburant. Son
livre Traité chimique de l'air et du feu ne paraît
toutefois qu'en
1775.
Le chimiste français
Antoine Laurent Lavoisier (1743-1794) déclarera
également une découverte indépendante, en dépit d'une visite
antérieure de Priestley et d'une lettre de Scheele...
En étudiant plus précisément les phénomènes d'oxydation et
de combustion, Lavoisier réfuta la théorie phlogistique
(chaleur constituée d'un fluide nommée phlogistique) et
classa l'oxygène en élément chimique. Dans son livre Sur
la combustion en général publié en 1777, il démontre
que l'air est un mélange de deux gaz : l'« air vital »
essentiel à la respiration et à la combustion et l'azote. Le
nom sera ensuite modifié en "oxygène", Lavoisier pensant à tort
que l'oxygène est un constituant de tous les acides. C'est
en réalité l'hydrogène. L'oxygène n'est pas acidifiant mais
oxydant. |

Priestley

Scheele

Lavoisier |

Côté chimie, l'oxygène est l'élément de numéro atomique 8 et de
symbole O faisant partie des non-métaux et plus
spécifiquement des chalcogènes.
L'oxygène est, en masse, le troisième élément le plus abondant
de l'Univers après l'hydrogène et l'hélium mais le plus abondant
des éléments de l'écorce terrestre :
-
88,8 % de la masse des
océans, sous la forme d'eau H2O
-
49,2 % de la masse de
l'écorce terrestre, en particulier sous forme d'oxydes et de
silicates
-
23,1 % de la masse de
l'air, sous forme de dioxygène ou d'ozone, soit 1,2×1015
tonnes, soit 20,9% du volume total de
l'atmosphère.
-
62,5 % de la masse du
corps humain (au travers essentiellement de l'eau)
-
jusqu'à 88 % de la
masse de certains animaux marins.
L'oxygène est en effet un
composant essentiel des molécules qui se retrouvent dans tout
être vivant : acides aminés, sucres, etc.
La densité d'espèces
vivantes est plus importante dans les eaux polaires en raison de
la plus forte concentration d'oxygène (augmentation de la
solubilité de l'oxygène à basses températures). Au contraire,
les eaux polluées, via notamment le développement des algues,
réduisent la teneur en dioxygène et donc la vie aquatique.
Les activités humaines,
notamment la combustion de 7 milliards de tonnes de combustibles
fossiles chaque année, ont un impact négligeable sur la
quantité de dioxygène dans l'atmosphère. Ce n'est
malheureusement pas le cas pour la teneur en composés
inorganiques, voir la section "Pollutions
de l'air".

A l'origine dépourvue de dioxygène, notre
planète à généré celui-ci il y a 2,8 milliards d'années (à
quelques années près) grâce à la photosynthèse des
végétaux, des algues et des cyanobactéries: absorption de
dioxyde de carbone CO2 et production de dioxygène. L'écosystème
marin produirait selon les théories de 45% à plus de 70% du
dioxygène de l'atmosphère.
Cette photosynthèse peut se décrire de
manière très poétique par la formule:
6 CO2 + 6 H2O + photons
= C6H12O6 + 6 O2
c'est-à-dire dioxyde de carbone + eau + lumière solaire =
glucose + dioxygène. Il fallait y penser !
On estime qu'il faudrait environ 2 000 ans à
la photosynthèse pour produire la totalité du dioxygène présent
aujourd'hui dans l'atmosphère.
|
Au niveau de la
stratosphère et sous l'effet du rayonnement solaire, du
dioxygène s'est brisé en deux atomes d'oxygène pour
ensuite se recombiner avec une molécule de dioxygène,
formant l'ozone et sa fameuse couche, bouclier contre
les dangereux ultraviolets. C'est ce qui a permis aux
premières plantes de quitter les océans il y a près de
475 millions d'années...
Dans le même temps
et sous l'effet des mêmes rayonnements, les molécules
d'eau présentes dans l'air sont décomposées en dioxygène et dihydrogène. |
 |
Le dioxygène est indispensable à tout écosystème :
production de dioxygène via les êtres vivants photosynthétiques
et consommation de dioxygène via la respiration et la
décomposition des animaux et des plantes. Chacun de ces
transferts correspond tous les ans à environ 1/2000 de la
totalité de l'oxygène atmosphérique.
Le dioxygène est le carburant nécessaire au
fonctionnement des cellules chez tous les organismes aérobies,
ce que l'on appelle la "respiration cellulaire". La
consommation de dioxygène est ainsi un indice de bonne activité
cellulaire, malheureusement mise à mal par le stress et les
différentes pollutions. Voir la section
oxygénation cellulaire.
Certaines bactéries sont par contre dites "anaérobiques
strictes" c'est-à-dire non résistantes à l'oxygène. C'est par
exemple le cas du bacille du Tétanos, raison pour laquelle
seules les plaies profondes, sans contact avec l'air ambiant et
sans saignement, sont à risque. L'oxygène plus efficace que le
vaccin (totalement inefficace puisque le Tétanos est une maladie non-immunisante) ? Chut, surtout ne pas gêner la
peur du Tétanos liée au
business de la vaccination...
Fermons la parenthèse.
Le plus grand carnage à cause de l'oxygène
eut lieu (dans la plus grande indifférence) lors de la
"Grande Oxydation" il y a environ 2,4 milliards d'années: cette
crise écologique majeure mena à l'extinction les organismes
anaérobies qui peuplaient alors la planète, permettant aux
organismes aérobies de prendre le relais. Tant mieux pour nous !
Chez l'homme et les autres vertébrés, le
transport du dioxygène vers l'ensemble de l'organisme est assuré
essentiellement par l'hémoglobine, une protéine que l'on
trouve essentiellement à l'intérieur des globules rouges du
sang. Un litre de sang arrive ainsi à dissoudre et à transporter
200 cm3 de dioxygène.
Un adulte au repos inhale entre 1,8 et 2,4 grammes de dioxygène
par minute. Un calcul savant permet ainsi d'extrapoler aux plus
de six milliards de tonnes de dioxygène inhalés tous les ans
par l'humanité.
|
Juste pour le
plaisir des yeux et afin de comprendre que nous nous
limitons ici à l'essentiel, voici sur la droite le diagramme
des orbitales moléculaires (OM) de O2,
c'est-à-dire l'interaction entre deux atomes d'oxygène
pour former une molécule de dioxygène.
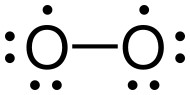
Déjà un peu plus
simple, ci-dessous, à gauche, la représentation courante
de Lewis du dioxygène: une liaison double, chaque atome
portant également deux doublets d'électrons non
partagés. A droite, une structure qui rend compte (si
si!) du paramagnétisme de cette molécule. Pour plus de
détails, direction Wikipedia!
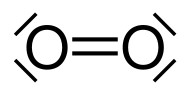
 |
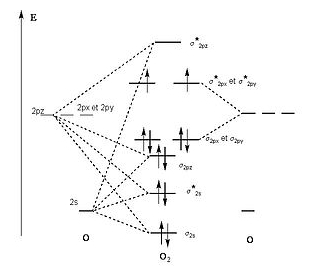 |
Evoquons juste ici que les deux atomes d'oxygène sont liés chimiquement
l'un à l'autre dans un état triplet et que cet "état triplet de l'oxygène",
exprimé par 3O2,
est l'état fondamental de la molécule de dioxygène. Dans cet
état normal, la molécule est
paramagnétique, c'est-à-dire qu'elle acquiert une aimantation
sous l'effet d'un champ magnétique.
L'oxygène singulet (Singlet en anglais) est le nom donné à plusieurs espèces excitées
de la molécule de dioxygène. Dans la nature, ce type d'oxygène
très énergétique et réactif se forme durant la photosynthèse à
partir de l'eau et de l'énergie solaire. Il est également produit
dans la troposphère grâce à la photolyse de
l'ozone par des rayons lumineux de courte
longueur d'onde ainsi que par le système
immunitaire comme une source d'oxygène
actif. Il est enfin produit par la technologie d'oxygénation
cellulaire
Airnergy afin de lutter contre
l'hypoxie, c'est-à-dire le manque d'oxygène au niveau
cellulaire. Sur le
paradoxe de l'oxygène, indispensable à la vie mais vecteur
d'oxydation et de radicaux libres, voir la section
Radicaux
libres. Sources (de savoir):
Wikipedia
|